- Il primo blog scritto da un dentista su Economia, Management e Marketing
Nella Srl odontoiatrica le prestazioni accessorie sono un costo deducibile
16 Gennaio 2024
In arrivo il concordato fiscale preventivo
1 Febbraio 2024Dispositivi medici in odontoiatria e Regolamento MDR
Con circa sette anni di ritardo è iniziata, quest’anno, la controversia sugli impianti dentali e l’obbligo di registrazione dei dispositivi medici. Nella consueta polarizzazione della discussione, ai più sono sfuggite le questioni importanti. La prima è che la vera differenza tra un obbligo ed un atto volontario risiede nel rischio e nei profili di responsabilità che il primo comporta quando viene accettato. La seconda è che la tutela della categoria deve seguire logiche di competenza, di sacrificio personale e di ricerca continua della verità. L’incertezza non è mai una valida ragione per abbandonarsi alla via più semplice.

Il tema dei dispositivi medici in odontoiatria è alquanto dibattuto, soprattutto quando fa riferimento agli obblighi di Registrazione UDI.
La normativa, come al solito, è complessa e non omogenea. Originariamente di derivazione europea, è stata poi rimaneggiata dagli Stati membri con decreti attuativi che la calano nella realtà di ciascuno di essi. E’ anche il caso dell’Italia.
Le aree grigie delle norme sono state, come sempre, oggetto di discussione ed interpretazioni. Anche noi abbiamo fatto la nostra parte, in compagnia di associazioni sindacali, organismi ordinistici a vari livelli, enti tecnici, aziende commerciali, ecc.
Il risultato è che, alla data di pubblicazione di questo articolo e qualche settimana dopo l’entrata in vigore dei provvedimenti, molti dentisti non sanno ancora cosa fare: cosa è obbligatorio, cosa non lo è, quali rischi sono legati alle varie scelte adottate, i tempi di attuazione e le modalità di esecuzione delle attività.
Come di consueto, su questo blog, partiamo dall’analisi dettagliata delle norme. Ci occuperemo esclusivamente dei dispositivi medici di interesse dell’odontoiatra: impianti dentali e abutments.
In un secondo tempo proveremo a dare indicazioni pratiche e anche in questo caso ci focalizzeremo esclusivamente sull’obbligo di Registrazione UDI dei dispositivi.
Il punto di partenza, ineludibile per ogni dentista titolare di studio, è che solo la conoscenza completa delle norme consente di prendere decisioni consapevoli. Questo concetto vale quotidianamente in ambito clinico, ma anche in quello fiscale e amministrativo.
Il Regolamento UE 2017/745 sui dispositivi medici
La prima cosa da sottolineare è che il Regolamento UE 2017/745 risale, appunto, al 2017. Quindi il suo testo è noto da circa 7 anni.
Non è un caso se, nei nostri precedenti articoli, l’argomento era già stato trattato, sia in ordine all’obbligo della registrazione degli impianti dentali sia in relazione ai dispositivi medici su misura ed ai processi clinici chair side.
Le conclusioni a cui eravamo arrivati erano le stesse di oggi ma con un vantaggio di anni rispetto alla disputa occorsa a Gennaio 2024. Non è accettabile che si inizi a discuterne solo ora, soprattutto negli ambienti deputati a trasmettere informazioni o ad orientare i comportamenti della comunità professionale.
Forse un po’ di nodi si potevano risolvere da tempo a beneficio della categoria. Il rischio della continua rincorsa all’urgenza è di combattere solo battaglie di retroguardia: non si è mai in prossimità del fronte, ma sempre qualche passo indietro.
A titolo di premessa generale, è bene sapere che il Regolamento UE 2017/745 non è neppure la prima legge europea in materia di dispositivi medici. In particolare l’attuale Regolamento modifica e sostituisce:
- la direttiva 2001/83/CE,
- il regolamento (CE) n. 178/2002,
- il regolamento (CE) n. 1223/2009,
- le direttive 90/385/CEE e 93/42/CEE.
L’articolo di nostro interesse, per gli scopi che ci proponiamo, è l’Art. 18, rubricato con il titolo: Tessera per il portatore di impianto e informazioni che devono essere fornite ai pazienti portatori di impianto.
Parleremo anche di questo argomento al prossimo Corso di Management e Organizzazione per processi. Se ti interessa iscriviti al questo link Iscrizione corso Management. Ti aspettiamo insieme allo staff del tuo studio.
Il contenuto dell’art. 18
L’art. 18 del Regolamento EU 2017/745 è quello che riguarda gli odontoiatri perchè si occupa degli impianti in genere e degli impianti dentali come sottoinsieme specifico.
E’ bene precisare fin da subito che, per il legislatore, gli “impianti” o i “dispositivi impiantabili” sono un insieme molto più ampio di quello cui i dentisti sono abituati a pensare. Il legislatore ha in mente l’interesse generale dei pazienti e non solo quello di competenza odontoiatrica.
Nella nozione generica di impianto, quindi, ricadono anche le protesi valvolari, il cristallino artificiale, un pacemaker o una protesi d’anca, tanto per fare degli esempi. Una visione troppo odontocentrica delle norme non ci permette di avere la prospettiva ampia del legislatore e di cogliere il senso stesso della legge.
A riprova di ciò, nei passaggi che citeremo, notiamo come il legislatore, quando ha sentito il bisogno di rivolgersi specificamente all’odontoiatria, lo ha fatto in modo esplicito. Andiamo dunque con ordine.
Nel primo comma dell’art. 18, si dispongono regole per i fabbricanti dei dispositivi impiantabili in generale, prescrivendo quanto segue:
Il fabbricante di un dispositivo impiantabile fornisce insieme a quest’ultimo:
- informazioni che consentono di identificare il dispositivo, tra cui la denominazione del dispositivo, il numero di serie, il numero di lotto, l’UDI, il modello del dispositivo, nonché il nome, l’indirizzo del sito web del fabbricante;
- avvertenze, precauzioni o misure che devono essere prese dal paziente o da un operatore sanitario in relazione a interferenze reciproche con influenze esterne ragionevolmente prevedibili, esami medici o condizioni ambientali;
- informazioni sulla vita utile attesa del dispositivo e su ogni follow-up necessario;
- ogni altra informazione atta a garantire un uso sicuro del dispositivo da parte del paziente, comprese le informazioni di cui all’allegato I, punto 23.4, lettera u). 5.5.2017 L 117/31 Gazzetta ufficiale dell’Unione europea.
Le informazioni di cui al primo comma sono fornite per essere messe a disposizione del paziente cui è stato impiantato il dispositivo mediante qualsiasi mezzo che consenta un rapido accesso alle informazioni stesse e sono redatte nella lingua stabilita dallo Stato membro interessato. Le informazioni sono redatte in modo da essere facilmente comprensibili per un utilizzatore profano e sono aggiornate ove necessario. Gli aggiornamenti delle informazioni sono messe a disposizione del paziente attraverso il sito web di cui al primo comma, lettera a).
Inoltre il fabbricante fornisce le informazioni di cui al primo comma, lettera a) su di una tessera per il portatore di impianto consegnata insieme al dispositivo.
Teniamo sempre a mente che quando si parla di tessera per il portatore dell’impianto, questo potrebbe essere una protesi endoaortica come anche una protesi oculare.
Nel secondo comma si prescrive quanto segue:
Gli Stati membri impongono alle istituzioni sanitarie di mettere a disposizione di tutti i pazienti cui è stato impiantato il dispositivo le informazioni di cui al paragrafo 1, mediante qualsiasi mezzo che consenta un rapido accesso alle informazioni stesse, insieme alla tessera per il portatore di impianto, che deve riportare la loro identità.
In effetti anche il nostro Paese ha provveduto ad emanare i provvedimenti richiesti dal Regolamento UE 2017 745, con un Decreto Ministeriale che analizzeremo di seguito e che si riferisce agli stessi impianti identificati ed esclusi dal Regolamento UE stesso.
In effetti, il Regolamento UE, prima di estinguere la questione, ci tiene a precisare che alcuni dispositivi implantari devono ritenersi esclusi dagli obblighi appena descritti. Questi dispositivi sono elencati nel terzo comma, dove si dice che:
I seguenti impianti sono esentati dagli obblighi di cui al presente articolo: materiali di sutura, graffette, materiali di otturazione dentale, apparecchi ortodontici, corone dentali, viti, cunei, placche e protesi, fili, chiodi, clip e connettori. Alla Commissione è conferito il potere di adottare atti delegati conformemente all’articolo 115 al fine di modificare questo elenco mediante l’aggiunta di ulteriori tipi di impianti o la rimozione di impianti.
A riprova del fatto che il legislatore identifica gli impianti con una accezione molto ampia, nell’elenco figurano dispositivi come le graffette o le corone dentali, le otturazioni o i cunei, qualunque cosa vogliano dire queste parole, prima in inglese e poi in italiano.
Una cosa è certa: la sua attenzione era particolarmente rivolta al mercato odontoiatrico ed alla professione del dentista perchè su alcuni di questi impianti non ci sono dubbi: oltre alle corone dentali e alle otturazioni, anche gli apparecchi ortodontici, le viti e i connettori, sono certamente attribuibili al mondo odontoiatrico.
Da notare che la stessa esclusione viene ribadita all’art. 52, in relazione agli obblighi per i fabbricanti. L’art. infatti prescrive:
Tuttavia, per i dispositivi impiantabili della classe IIb, a eccezione di materiali per sutura, graffette, materiali per otturazioni dentarie, apparecchi ortodontici, corone dentali, viti, cunei, placche e protesi, fili, chiodi, clip e connettori, la valutazione della documentazione tecnica di cui all’allegato IX, punto 4, è applicata a ogni dispositivo.
Da una prima lettura della norma sembrerebbe dunque di poter ragionevolmente escludere, dal novero degli impianti generici, gli impianti dentali, tanto è vero che il legislatore ha sentito l’esigenza di farlo: anche le componenti fisse delle terapie odontoiatriche sono state isolate dal resto degli impianti medici.
Il Decreto Ministeriale 11 Maggio 2023
Il nostro Paese recepisce le indicazioni del Regolamento UE 2017/745 con il Decreto Ministeriale 11 maggio 2023, pubblicato in Gazzetta Ufficiale il 18 Luglio 2023, Serie generale n. 166.
Nel Decreto Ministeriale, all’art. 3 comma 2, si legge quanto segue:
Per i dispositivi di classe III, diversi dai dispositivi impiantabili, e per i dispositivi impiantabili di classe IIb, ad eccezione dei dispositivi indicati nel paragrafo 3 dell’art. 18 del regolamento (UE) 2017/745, le istituzioni sanitarie e gli operatori sanitari di cui all’art. 1, comma 1, registrano e conservano gli UDI dei dispositivi che hanno ricevuto.
In sostanza vi è un perfetto allineamento del nostro Paese alle disposizioni comunitarie.
Tra gli impianti esclusi dall’obbligo sono certamente ricompresi gli impianti odontoiatrici: otturazioni, corone, viti, connettori, apparecchi, ecc. Pur non essendo tenuto a farlo, il legislatore italiano ha richiamato esplicitamente l’art. 18 del Regolamento UE 2017/745, sottolineando dunque l’importanza di questa esclusione nella applicazione della norma anche in Italia.
Se si considera che il Regolamento UE è costituito, nella sua versione italiana, da ben 175 pagine, 17 allegati e 123 articoli, difficile pensare che si tratti di un caso, se proprio l’art. 18 viene richiamato in un testo di legge (quello italiano) che è di sole 2 pagine e 7 articoli.
Parleremo anche di questo argomento al prossimo Corso di Management e Organizzazione per processi. Se ti interessa iscriviti al questo link Iscrizione corso Management. Ti aspettiamo insieme allo staff del tuo studio.
Il significato delle parole e i dubbi sugli impianti dentali
Nonostante questa evidenza palmare, per motivi incomprensibili in una logica di indipendenza intellettuale, alcuni commentatori, politici, sindacalisti, hanno avvertito il bisogno di disconoscere gli impianti dentali dalle parole viti, fili, chiodi, placche, pur impiegati nel testo della legge. Allo stesso modo hanno inteso escludere gli abutement dalla espressione connettori.
E’ davvero strano: tutti coloro che praticano l’odontoiatria, anche gli abusivi, sanno che un impianto dentale è costituito da una vite, una corona e una connessione. Quando la vite non è presente, al suo posto troviamo un chiodo, una placca o un filo e, in effetti il legislatore, per non sbagliarsi, li ha messi tutti.
Quali che siano le ragioni per cui qualcuno voglia, pur nel legittimo dubbio semantico di una parola, escludere d’impulso il suo significato più immediato, comune e spontaneo, onde ricondurlo a significati più desueti ed originali, non è dato di sapere a noi che scriviamo. Ne prendiamo solo atto.
Quale sia poi l’intenzione con cui questo comportamento venga adottato da chi avrebbe uno specifico mandato contrario, ovvero quello di tutelare gli interessi di chi da tale norma potrebbe derivarne obblighi, responsabilità o danni, è davvero un mistero.
Si tratterebbe, peraltro, di un falso problema, perchè il dubbio semantico potrebbe essere rinviato al legislatore stesso (quello europeo o quello italiano) già nel 2017, ma non viene fatto. Si preferisce accoglier e per buona l’interpretazione più restrittiva, meno favorevole e più forzata, escludendo dall’insieme impianti in forma di viti o chiodi, placche, ecc., proprio l’impianto a forma di vite che si posiziona in bocca, pur essendo evidente che il legislatore ha avuto un occhio di riguardo per il mondo odontoiatrico.
Si è arrivati al paradosso di riconoscere come impianto odontoiatrico una otturazione dentale, ma non una vite. Anche volendo considerare genuina questa posizione interpretativa è possibile dirimere il dubbio semantico affidandosi ad una fonte terza autorevole, visto che non è stato posto il quesito al legislatore?
Sembra incredibile, ma risulta che qualcuno avesse risposto al quesito, in modo tecnico, con largo anticipo e in tempi non sospetti.
Il Position Paper TEAM NB del 2020
In primo luogo dobbiamo chiarire cos’è un position paper e chi è il soggetto che lo redige.
Un position paper è un documento con il quale un soggetto esprime la propria opinione su un dato argomento oggetto di controversia o potenziale disaccordo. In ambito scientifico i position papers vengono elaborati, per esempio, dalle società scientifiche per documentare ed orientare i comportamenti di medici ed odontoiatri verso quelle che si ritengono essere le best practices. Un altro esempio di position papers è rappresentato da quello giuridico. In questo caso si cerca di dare una interpretazione ufficiale su norme che siano dubbie, confliggenti o controverse.
In ambito tecnico, invece, il position paper ha lo scopo di definire in modo ufficiale e condiviso un’opinione su un certo argomento sulla base del giudizio di esperti.
Il valore del position paper è poi intimamente legato a quello dei soggetti che esprimono tale opinione, singolarmente o in modo congiunto. Tanto più alta è la reputazione di chi redige il position paper tanto più attendibile sarà l’opinione espressa.
Nel caso specifico in questione il TEAM NB , come si legge dal suo sito, è l’Associazione Europea dei Dispositivi Medici degli Organismi Notificati. Oggi l’associazione conta 42 soci. Questi 42 membri rappresentano 20 paesi diversi. Questa associazione promuove standard elevati e tutela gli interessi degli Organismi Notificati. E’ un ente accreditato presso la Commissione Europea sui Medical devices.
Secondo la stessa Commissione Europea un Organismo Notificato:
è un’organizzazione designata da uno Stato membro (o da altri paesi nell’ambito di specifici accordi) e incaricata di valutare la conformità di determinati prodotti prima che vengano immessi sul mercato.
In particolare TEAM NB è organismo notificato dagli Stati Membri proprio per la verifica della conformità alla normativa dei dispositivi medici. Ora, è molto probabile che tale ente notificato abbia sufficiente autorevolezza per esprimere un parere tecnico sul significato delle parole viti, chiodi, fini, connettori che si trovano all’interno dei testi di legge appena descritti.
Il Team NB Position paper on Dental Implants viene pubblicato in data 11 marzo 2020, tre anni dopo la pubblicazione del Regolamento UE 2017/145 e tre anni prima di questo articolo. Segno che prima di scrivere quello che hanno scritto ci hanno pensato bene e che c’è stato abbastanza tempo per leggerlo da allora ad oggi.
Citando solo le conclusioni del documento si legge, letteralmente in inglese, quanto segue:
Dental implants and dental implant abutments can be regarded as exempted implants according to
article 18 and 52 based on the following points:
- The exemption list in article 18 (3) and article 52 (4) of the MDR contains general terminology leaving room for wide interpretation.
- Devices in the exemption list are required to possess a “well-established technology” [article 52].
- Identification of dental implant abutments as connectors and dental implants as screws is reasonable.
- State-of-the-art manufacturing technologies and surgical procedures for dental implant abutments and dental implants are used.
Ora abbiamo una fonte attendibile, semmai fosse davvero servita, per farci dire che con l’espressione impianto a forma di vite o chiodo o altro, ricompreso in un gruppo di altri impianti odontoiatrici (corone, otturazioni, apparecchi, ecc.), dobbiamo intendere anche l’impianto dentale.
Allo stesso modo con l’espressione di impianto in forma di connettore, ricompresa anch’essa in un gruppo di altri impianti odontoiatrici (corone, otturazioni, apparecchi, ecc.), dobbiamo intendere anche la connessione o abutment dell’impianto dentale stesso.
Per quale masochistica ragione i dentisti dovrebbero, ancora, respingere l’esclusione degli impianti dentali dalla norma?
Parleremo anche di questo argomento al prossimo Corso di Management e Organizzazione per processi. Se ti interessa iscriviti al questo link Iscrizione corso Management. Ti aspettiamo insieme allo staff del tuo studio.
La posizione delle aziende che producono impianti dentali
Il mercato degli impianti, come tutti i mercati saturi e ipercompetitivi, è caratterizzato da comportamenti opportunistici e strategie aggressive. Non bisogna stupirsi se alcune aziende adottano comportamenti di un tipo e altre di un altro tipo. E’ normale.
Tuttavia da questi comportamenti emergono alcuni elementi fattuali che complicano ulteriormente la situazione.
Succede che quasi tutte le aziende note hanno chiesto le certificazioni previste dal nuovo Regolamento UE, ma solo alcune di esse le abbiano ricevute per tempo, rispetto alla scadenza prevista di gennaio 2024. E’ anche probabile che qualcuna, forte delle considerazioni espresse sopra, non abbia mai richiesto tale certificazione. Noi che scriviamo questo articolo, probabilmente, non lo sapremo mai. Ma il fatto non è rilevante.
Quello che invece rileva è che a Gennaio 2024 alcune aziende produttrici di impianti dentali (o che li commercializzano nel nostro Paese), sono dotate di certificazione ai sensi del nuovo Regolamento UE, altre invece no. Le seconde risultano invece certificate ai sensi della precedente normativa, la Direttiva 93/42/CEE, sostituita da quella attuale.
Succede quindi che queste, all’indomani del presunto obbligo, scrivono ai loro clienti una comunicazione praticamente identica, nella quale si dice che le aziende che non hanno conseguito la nuova Certificazione continuano, legittimamente, ad operare in virtù di quella precedente. Dal momento che gli obblighi di Registrazione UDI sono applicabili solo a quelli che, diligentemente, hanno conseguito la nuova Certificazione ai sensi del Regolamento UE, chi opera in virtù della vecchia normativa, paradossalmente, è esentato da tale obbligo.
Se leggiamo il testo della norma, con grande sorpresa, si scopre che hanno perfettamente ragione. L’art. 1, comma 2, del Decreto Ministeriale maggio 2023, infatti delimita il campo di applicazione del Regolamento UE 2017/745, e prescrive:
Il presente decreto si applica ai dispositivi medici marcati CE ai sensi del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio del 5 aprile 2017.
Se si applica solo a quelli, evidentemente non si applica agli altri. A conti fatti, chi non si è adeguato alla nuova disciplina, indipendentemente dal fatto che sia stato intenzionale oppure no, ha avuto un vantaggio organizzativo e commerciale, che, a cascata, si distribuisce sui suoi clienti, ovvero gli odontoiatri che sono esclusi da tale obbligo anche senza dover invocare l’esclusione sopra descritta.
Conclusioni
Leggendo questo articolo ogni dentista avrà ora gli strumenti per decidere se ottemperare agli adempimenti richiesti dal Regolamento UE 2017/745 e dal Decreto Ministeriale 11 maggio 2023. Si formerà una idea propria ed agirà di conseguenza.
In ogni caso rimane di fondamentale importanza sapere se l’eventuale adesione all’obbligo di registrazione dei dispositivi medici in ambito odontoiatrico viene fatta su base volontaria oppure no. Giacché in un caso non saranno previste sanzioni mentre nell’altro le sanzioni previste arrivano a 24.000 euro.
Vale anche la pena ricordare che la cogenza o meno di un obbligo modifica in modo sostanziale i profili di rischio e di responsabilità, sia sul piano civilistico che su quello penale, di tutti i soggetti coinvolti, sia in ambito amministrativo che medico legale.
Qui non si tratta di pigrizia o diligenza, si tratta piuttosto di sentirsi garantiti dai propri rappresentanti associativi, ben sapendo che questo sarebbe solo l’ultimo di una serie interminabile di adempimenti che sono stati calati sulla professione.
A titolo puramente esemplificativo e non certamente esaustivo, soffermiamoci un momento sul senso generale della tabella seguente e sulla necessità che vengano riviste le nostre politiche sindacali nel breve e nel lungo periodo:
Nella tabella mancano gli obblighi sui dispositivi medici. Non saprei dire in quanti tra i colleghi sentano il bisogno di aggiungere una riga, soprattutto se esiste anche solo una possibilità per non farlo.
****************************************************
Aggiornamento del 23/02/2024
GRAZIE AD ANDI E’ ARRIVATA IN DATA DI IERI LA CONFERMA DELL’OBBLIGO UDI
Sembra arrivata, almeno per ora, una parola definitiva sull’obbligo di registrazione UDI per gli Impianti dentali.
Nonostante il dubbio interpretativo sulla norma (sollevato proprio da Dentista Manager), il maggiore sindacato italiano dei dentisti è riuscito ad ottenere dal Ministero della Salute le indicazioni contenute nell’ All. 1 – Ministero della Salute risposta su quesito UDI.
Siamo sicuri che Andi abbia tentato in tutti i modi di ostacolare questo nuovo obbligo in capo ai dentisti e siamo anche sicuri che si sia fatta portavoce degli interessi della categoria, riferendo al Ministero che il più importante organismo tecnico europeo aveva già escluso gli impianti dentali dagli obblighi previsti dalla MDR 745/2017.
Nonostante questi sforzi pare che questo ennesimo adempimento sia del tutto inevitabile e gli odontoiatri saranno costretti ad adempiere.
E’ un vero peccato, visto che perfino il Ministero riconosce che “fin dal 2021, diverse interlocuzioni a livello di UE sia con le autorità competenti degli altri Paesi membri che con la Commission Europea, NON HANNO ANCORA CONDOTTO AD UNA INTERPRETAZIONE UNIVOCA”.
Non rimane che auspicare che in futuro, vista la capacità persuasiva di alcuni rappresentanti sindacali, ci si astenga da iniziative chiarificatrici in favore della categoria. Risolvere un dubbio esplicito con la risoluzione più restrittiva non pare davvero un grande successo.
Parleremo anche di questo argomento al prossimo Corso di Management e Organizzazione per processi. Se ti interessa iscriviti al questo link Iscrizione corso Management. Ti aspettiamo insieme allo staff del tuo studio.

 Parleremo anche di questo argomento al prossimo
Parleremo anche di questo argomento al prossimo 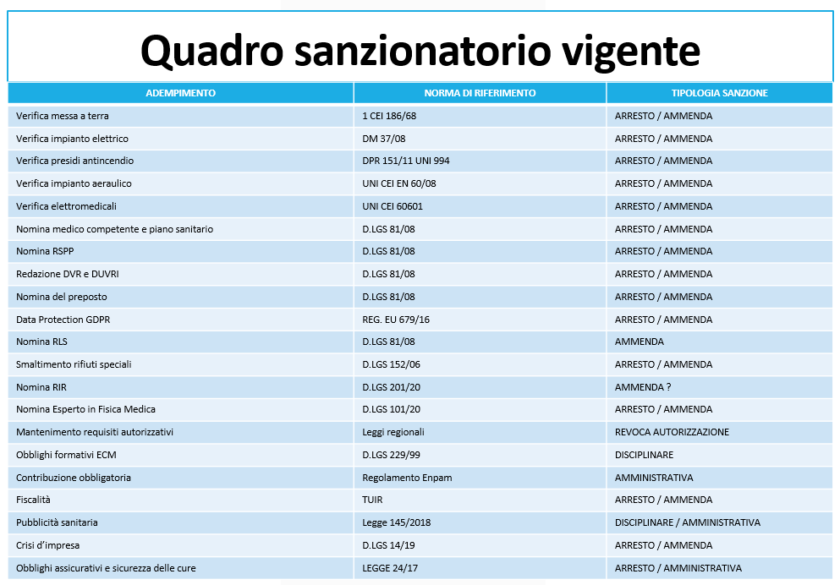




1 Commento
[…] Dispositivi medici in odontoiatria e Regolamento MDR https://www.dentistamanager.it/dispositivi-medici-impianti-dentali/ […]